
-
中文 | EN

中文 | EN
发布时间:2020-05-16 00:00:00.0
近年来,蛋白质相分离被发现广泛存在于细胞中,驱动多种执行重要生物学功能的生物大分子凝聚体(biomolecular condensates)的形成,如压力颗粒,P-body等【1】。蛋白质相分离调控的紊乱会直接导致部分蛋白质从液-液相分离(liquid-liquid phase separation,LLPS)过渡到液-固相转化(liquid-solid phase transition,LSPT),以至于形成不可逆致病淀粉样聚集(amyloid aggregation)。这一过程与包括渐冻人症(amyotrophic lateral sclerosis,ALS)在内的多种神经退行性疾病的发病密切相关【2】。然而,相对于几乎每周都有新发现报道的蛋白相分离生物学功能的研究,针对蛋白质的相分离在细胞中是如何被精密调控以及蛋白质在相分离状态下的内稳态是如何被维持等关键科学问题的研究目前还比较匮乏。
2020年3月30日,中国科学院上海有机化学研究所生物与化学交叉中心刘聪课题组与上海交通大学Bio-X研究院李丹课题组合作在NatureStructural & Molecular Biology上发表文章Hsp27 chaperones FUSphase separation under the modulation of stress-induced phosphorylation,发现分子伴侣-小热休克蛋白Hsp27在精密调控蛋白质的液-液相分离(LLPS),及液-固相转化(LSPT)中起到了至关重要的作用。

刘聪和李丹课题组长期合作致力于研究蛋白质不同形式相分离的结构基础,动态调控机制,以及在神经退行性疾病中的作用。前期研究揭示渐冻人症关键致病蛋白FUS及hnRNPA1的Low-complexity (LC) domain的不同区段介导蛋白的LLPS,LSPT及amyloid aggregation。ALS家族性遗传突变能够极大地加速LLPS向LSPT的转变【3,4】(详见BioArt报道:0.73Å,最高分辨率的结构揭示淀粉样聚集蛋白功能性可逆的精密调控分子机制;Nat Comm | 刘聪/李丹合作揭示渐冻人症致病蛋白hnRNPA1相分离的调控机制)。在本项工作中,两个课题组通过进一步合作研究,发现分子伴侣Hsp27精密调控FUS蛋白的LLPS及LSPT,并揭示Hsp27的翻译后修饰在调控FUS蛋白质相分离中至关重要的作用。
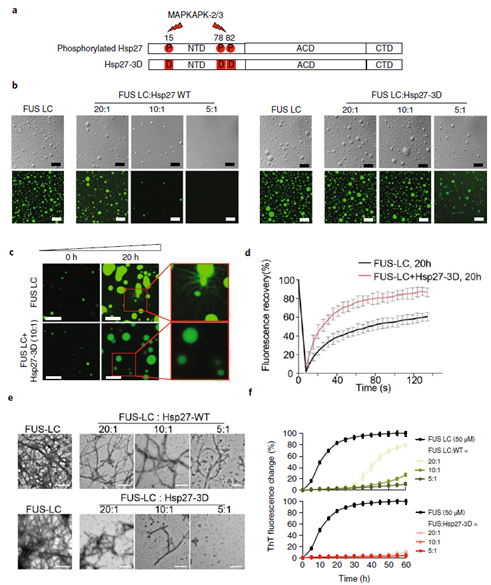
图1. N端磷酸化导致Hsp27与FUS co-LLPS,维持FUS的LLPS状态,并有效抑制FUS致病淀粉样聚集 (Liu, Z., et al. NSMB. 2020)
本工作发现,Hsp27在正常生理条件下以高聚体形式存在,并能有效抑制FUS的LLPS及LSPT。通过NMR滴定,PRE等实验方法,研究者发现高聚形式的Hsp27运用其固有无序结构的N端作用于FUS的LC结构域,并抑制其介导的FUS分子间相互作用以及相分离。细胞在压力应激条件下,Hsp27的 N端三个位点发生磷酸化(p-Hsp27),导致Hsp27高聚体部分解聚。更为重要的是,N端的磷酸化一方面极大的削弱了Hsp27抑制FUS蛋白 LLPS的能力,促进Hsp27与FUS在体外以及细胞内的压力颗粒中共分相(co-LLPS);另一方面加强了在co-LLPS状态下Hsp27抑制FUS蛋白 LSPT的能力(图1)。从而,Hsp27保护FUS能够稳定维持在功能性的LLPS状态,而非进一步转化形成ALS致病相关的amyloid aggregation。
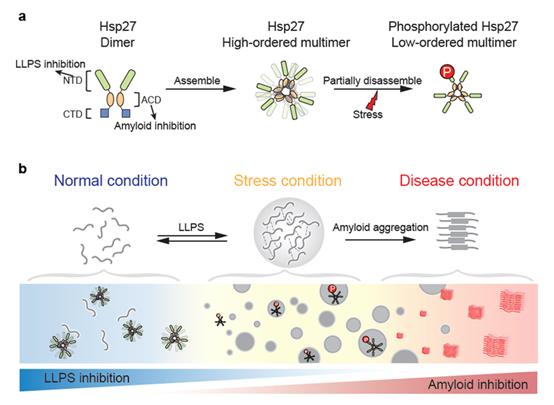
图2. 磷酸化介导的Hsp27分级调控FUS蛋白相分离的模式图 (Liu, Z., et al. NSMB. 2020)
综上,本工作揭示分子伴侣在调控蛋白质相分离,维持相分离状态下蛋白内稳态中的重要作用;阐释了翻译后修饰如何通过调控Hsp27的自组装形式,空间构象,以及分子伴侣活性来实现对ALS致病蛋白FUS 相分离的多层次精细动态调控(图2);加深了生物分子凝聚体蛋白稳态调控的认识;为理解蛋白相分离紊乱引起的相应神经退行性疾病的发病机理提供新的思路。
原文链接:
https://doi.org/10.1038/s41594-020-0399-3
参考文献:
1. Boeynaems S, et al., Protein Phase Separation: A New Phase inCell Biology.TrendsCell Biol. 2018 (6):420-435.
2. Patel, A. et al. A Liquid-to-Solid Phase Transition of theALS Protein FUS Accelerated by Disease Mutation. Cell. 2015162, 1066-77.
3. Luo F, et al., Atomic structures of FUS LC domain segmentsreveal bases for reversible amyloid fibril formation. Nat Struct MolBiol. 2018. (4):341-346.
4. Gui X, et al., Structural basis for reversible amyloids of hnRNPA1elucidates their role in stress granule assembly. Nat Commun. 2019. 10(1):2006.
