-
中文 | EN

中文 | EN
以潜在靶标蛋白结构及功能为导向,研发新颖、高特异性、高活性的小分子调节剂;以所研发出的新型调节剂作为信号通路探针,进一步研究其靶标蛋白在癌症、炎症或神经退行性疾病中的病理功能,及作为治疗靶点的潜力;优化先导化合物,研发临床治疗的候选药物。
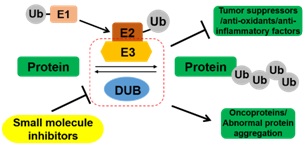
以小分子调节剂改善癌症、炎症或神经退行性疾病中异常的蛋白质稳态。细胞内控制各种蛋白质的浓度和构象的过程,统称为蛋白质稳态。泛素-蛋白酶体系统(UPS)与分子伴侣系统,共同调控着翻译过程中及之后的蛋白质稳态,而UPS对蛋白质浓度的调控尤其重要。泛素化过程是一种可逆而普遍的转录后修饰过程,经其标记的蛋白质被蛋白酶体识别并降解的过程广为人知;泛素化过程也调控着蛋白质的活性、定位、信号传导以及溶酶体或自吞噬降解。蛋白酶体的结构与功能已被广泛研究,其靶向药物Velcade于2003年已获FDA批准。而针对泛素化过程中核心组件——E3连接酶和去泛素化酶——的研究近年来如火如荼,正如20年前学界对激酶组研究新兴起的热潮。本课题组针对癌症、炎症或神经退行性疾病中一些相关的E3连接酶或去泛素化酶,研发新型的功能探针乃至临床候选药物。
1. E3连接酶小分子调节剂的研发
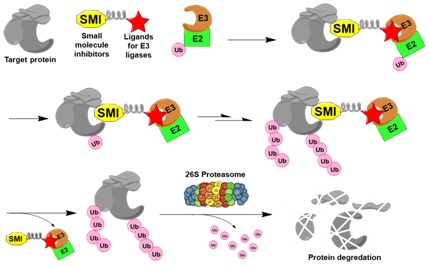
在泛素-蛋白酶体系统中,E3连接酶催化其底物特定位点的泛素化。目前已发现逾700个人源E3连接酶。在蛋白质稳态调控中,它们通常招募E2泛素结合酶,直接地或利用衔接蛋白识别底物。与仅40个成员左右的E2家族不同,多数E3连接酶对底物高度特异性地识别。近年来,相当多E3连接酶复合物的复杂结构被逐个解析,不但辅助阐明其功能机制,也提供了靶向药物设计的结构基础。针对E3连接酶的药物研发方兴未艾:在多发性骨髓瘤中,诱导CRBN对转录因子Ikaros泛素化的小分子调节剂——thalidomide及其类似物——已经获批;多个抑制MDM2对p53泛素化的抑制剂,或抑制CUL3衔接蛋白KEAP1与NRF2相互作用的小分子抑制剂,都处于临床后期评估中。本课题组针对特定E3连接酶——如CHIP和CRBN——研发新型的小分子调节剂,以1)抑制抗癌、抗氧化或抗炎因子的泛素化及降解;2)诱导致病蛋白的泛素化及降解。
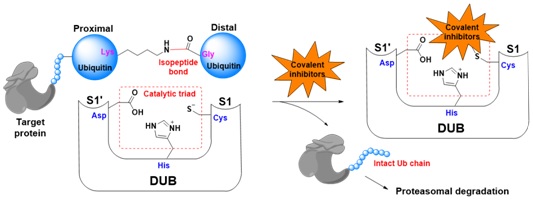
2.去泛素化酶小分子抑制剂的研发
去泛素化酶(DUB)与E3连接酶的功能正相反,负责剪切底物所修饰的泛素链。目前已有5大家族约95个人源去泛素化酶已被发现,其中4大家族都属于半胱氨酸蛋白酶。一些DUB已知的催化结构域晶体结构,揭示了DUB所共有的泛素结合区以及水解催化位点。在过去十年中,DUB作为癌症、炎症或神经退行性疾病的潜在治疗靶标越来越引人注目。一些致癌蛋白(如RAS或Myc)难以通过小分子抑制剂直接靶向,而抑制其DUB能间接降低其水平。正如早期的激酶抑制剂,目前所报道的仅40多个DUB抑制剂中,绝大多数在特异性或活性上并不理想。然后,如今已有相当多的高特异性激酶抑制剂已被发现,逾30个激酶药物已获批,还有逾百候选药物正处于临床评估当中;与此同时,类似DUB的其他半胱氨酸蛋白酶,也已有相关药物处于临床评估当中。这意味着,针对催化结构域彼此类似的DUB家族,系统性地研发出高特异性、高活性的抑制剂只是时间问题。本课题组针对疾病相关的DUB例如USP14、CYLD或A20,研发新型的高特异性、高活性的酶活性抑制剂。