
-
中文 | EN

中文 | EN
发布时间:2021-07-12 00:00:00.0
生物体中,蛋白质等大分子会通过液-液相分离动态组装成具有不同生理功能的生物大分子凝聚体1。正常细胞中,蛋白相分离始终处于精密的动态调控中,以维持生物大分子凝聚体的分相稳态及其正常生理功能;病理状态下,相分离调控紊乱会导致蛋白的液-固相转化并产生病理性蛋白聚集体,这一过程与诸多神经退行性疾病的发生发展密切相关2。
中科院上海有机所生物与化学交叉研究中心刘聪课题组长期致力于分子伴侣调控蛋白相分离及其在神经退行性疾病中作用的研究,前期工作中发现了分子伴侣Hsp40及Hsp27通过不同的方式动态调控蛋白相分离稳态并抑制病理性蛋白液-固相转化,阐明了分子伴侣在调控蛋白相分离稳态中的关键作用3, 4。同时,中科院上海有机所生物与化学交叉研究中心方燕姗课题组去年在一项发表于Molecular Cell的工作中与刘聪课题组合作,发现细胞应激时lncRNA NEAT1介导肌萎缩性侧索硬化症(ALS,俗称“渐冻人症”)关键致病蛋白TDP-43在细胞核中形成具有细胞保护功能的无膜、液滴状、高度动态可逆的TDP-43核体,而TDP-43的致病突变D169G会引起RNA结合缺陷,造成TDP-43应激核体组装异常,进而导致TDP-43过度出核并在胞浆中形成病理性聚集体5。
TDP-43蛋白具有很强的液-固相转化倾向,这一特性与ALS的病理发生密切相关。那么,当应激响应机制(如lncRNA NEAT1的高表达)被启动,TDP-43相分离被诱导并形成应激核体,正常细胞又是通过什么机制来调控TDP-43核体使其维持在具有高度动态性的“液滴状”而不发生病理性聚集的呢?基于以上科学问题,刘聪课题组与方燕姗课题组再度展开合作,发现分子伴侣Hsp70是维持TDP-43在细胞应激下的液-液相分离稳态、抑制TDP-43病理性聚集的关键分子,并进一步揭示了Hsp70通过结合TDP-43上保守的聚集核心区域行使该调控功能的分子机制。该研究工作于2021年7月8日在Cell Research在线发表题为“Hsp70 chaperones TDP-43 in dynamic, liquid-like phase and prevents it from amyloid aggregation”的论文。

该研究发现,细胞应激时伴随TDP-43核体的形成,Hsp70的表达水平急剧升高。同时,Hsp70蛋白被招募到细胞核中与TDP-43核体共定位(图1a-b)。体外实验表明,Hsp70能够与TDP-43发生共分相(图1c)。并且在此过程中,Hsp70一方面能够促进TDP-43蛋白从弥散状凝集成分相液滴;另一方面显著抑制了TDP-43液滴向固态转化的进程(图1d)。与之相呼应,细胞中敲低Hsp70的水平一方面减少急性应激时TDP-43核体的形成(图1e);另一方面加速持续应激时TDP-43核体的液-固相转化(图1f)。这些实验结果表明,分子伴侣Hsp70响应细胞应激,不仅可以促进具有细胞保护功能的TDP-43核体的形成,而且可以在持续应激中维持TDP-43核体的液态流动性、防止TDP-43核体发生异常聚集。进一步,液态核磁共振等实验结果揭示,Hsp70通过特异性识别和结合TDP-43低复杂序列结构域(LCD)中介导其聚集的保守区域(CR),来抑制TDP-43 LCD的病理性淀粉样聚集及液-固相转化(图1g-i)。
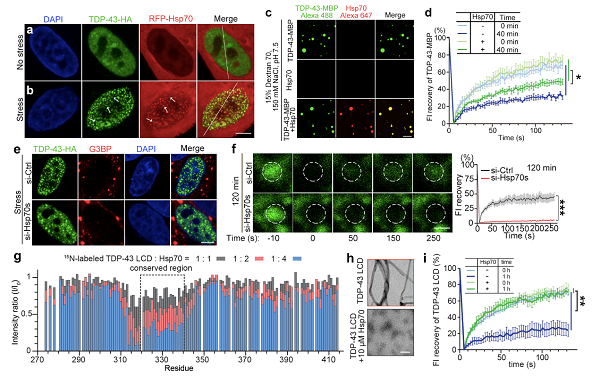
图1 Hsp70协助TDP-43核体的形成,并通过特异性识别和结合TDP-43 LCD的保守区域来抑制TDP-43核体的液-固相转化
接下来的工作中,研究人员探究了Hsp70与病理状态下的TDP-43蛋白异常聚集的关系。如图2a-e所示,TDP-43-K181E是一种已知的ALS致病突变,会在细胞核中形成异常聚集,特别是具有ALS病理特征的过度磷酸化的TDP-43聚集体。该团队的研究表明,过表达Hsp70能够减缓TDP-43-K181E核体发生液-固相转化,并显著减少细胞核中过度磷酸化的TDP-43-K181E病理性聚集体的大小(图2f-h)。
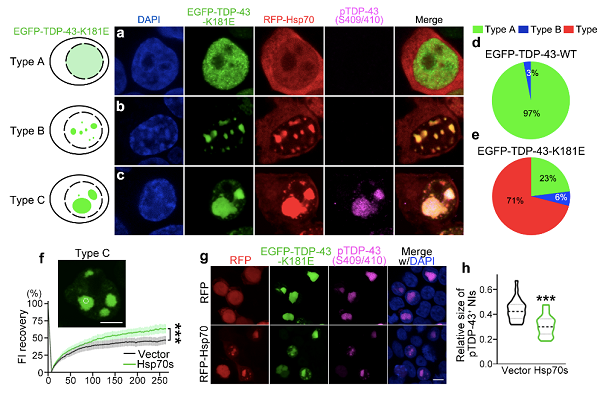
图2 过表达Hsp70改善ALS致病突变TDP-43-K181E在细胞核内的病理性聚集。
综上,该工作通过运用多种细胞生物学和生物物理学研究手段,最终得出以下结论:Hsp70通过与TDP-43蛋白中介导聚集的CR片段的相互作用,在细胞应激之初协助TDP-43蛋白分相,促进TDP-43核体的组装;当细胞应激持续发生时,Hsp70与TDP-43 CR之间的相互作用则阻止了由CR-CR相互作用介导的TDP-43核体的液-固相转化,从而防止TDP-43在细胞应激时过度凝聚成病理性蛋白聚集体(图3)。
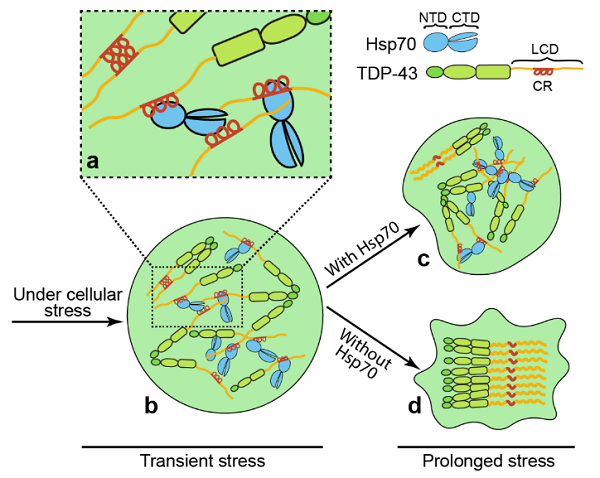
图3 Hsp70调控TDP-43核体组装及其稳态的模式图
值得一提的是,美国加州大学圣迭戈分校的Don Cleveland课题组今年二月在Science发表的一项工作报道了RNA结合域上模拟乙酰化修饰的TDP-43突变会在细胞核中形成空心的、具有核壳结构的蛋白凝聚体,而Hsp70也会被招募到其中并参与TDP-43不规则凝聚体的组装6。这两项工作从不同的角度揭示了Hsp70在调控TDP-43相分离稳态方面的重要功能,为理解ALS等神经退行性疾病的发病机理和研发相关疾病的干预手段提供了新思路。
参考文献
1. Banani, S.F., Lee, H.O., Hyman, A.A. & Rosen, M.K. Biomolecular condensates: organizers of cellular biochemistry. Nature reviews. Molecular cell biology 18, 285-298 (2017).
2. Shin, Y. & Brangwynne, C.P. Liquid phase condensation in cell physiology and disease. Science 357 (2017).
3. Liu, Z. et al. Hsp27 chaperones FUS phase separation under the modulation of stress-induced phosphorylation. Nature structural & molecular biology 27, 363-372 (2020).
4. Gu, J. et al. Hsp40 proteins phase separate to chaperone the assembly and maintenance of membraneless organelles. Proceedings of the National Academy of Sciences of the United States of America 117, 31123-31133 (2020).
5. Wang, C. et al. Stress Induces Dynamic, Cytotoxicity-Antagonizing TDP-43 Nuclear Bodies via Paraspeckle LncRNA NEAT1-Mediated Liquid-Liquid Phase Separation. Molecular cell 79, 443-458 e447 (2020).
论文链接:https://www.nature.com/articles/s41422-021-00526-5
