
-
中文 | EN

中文 | EN
发布时间:2021-10-08 00:00:00.0
程序性坏死(necroptosis)是一种可被调控的细胞死亡形式,已有大量研究发现程序性坏死参与多种炎症性疾病与神经退行性疾病致病过程。程序性坏死由程序性坏死复合物(necrosome)介导,necrosome是由RIPK1/RIPK3/MLKL 组成的蛋白复合物。虽然关于necrosome导致细胞膜破裂从而导致细胞死亡已经有大量研究,但是necrosome对细胞亚细胞结构的作用还并未有研究。
2021年9月20日,中科院上海有机化学研究所生物与化学交叉研究中心的袁钧瑛课题组在Proc Natl Acad Sci USA.上发表论文“Necroptosis activates UPR sensors without disrupting their binding with GRP78”对这一问题进行了探索。
作者利用邻位连接技术(Proximity ligation assay, PLA)对内源的necrosome进行可视化研究。该方法不仅可以检测体外培养细胞中的necrosome,对小鼠组织中necrosome也有很好的检测效果。在此基础上,作者探索了necrosome的亚细胞定位并发现有较多比例的necrosome定位在内质网(ER)中。内质网是细胞内可分泌蛋白的折叠场所,当蛋白折叠受阻时,内质网的未折叠反应(unfolded protein response, UPR)信号通路会被激活,UPR由定位在内质网上的三个感应蛋白PERK、IRE1、ATF6介导。作者发现necroptosis可以激活PERK,IRE1和ATF6信号通路,促进IRE1对其下游底物XBP1 mRNA的剪切,而被剪切的XBP1 mRNA可通过囊泡(Extracellular Vesicle)被释放。该发现提示了发生程序性坏死(necroptosis)的细胞可通过细胞外囊泡内的RNA组分发挥细胞间通讯作用。
此外,作者发现necroptosis激活UPR的机制与经典的UPR激活机制不同。在细胞静息状态下,分子伴侣GRP78与PERK、IRE1、ATF6的ER管腔内结构域(luminal domain)结合而抑制其激活。在经典UPR激活条件下,未折叠蛋白与GRP78结合,导致PERK、IRE1与GRP78解离而寡聚化激活。而necroptosis发生时,MLKL促使ER发生形态变化,GRP78与PERK,IRE1不发生解离,直接通过PERK的跨膜结构域(transmembrane domain)介导其激活。该发现揭示了necroptosis激活UPR信号通路的独特机制,加深了对于necroptosis和UPR信号通路介导的细胞间通讯及相关疾病的理解(图一)。
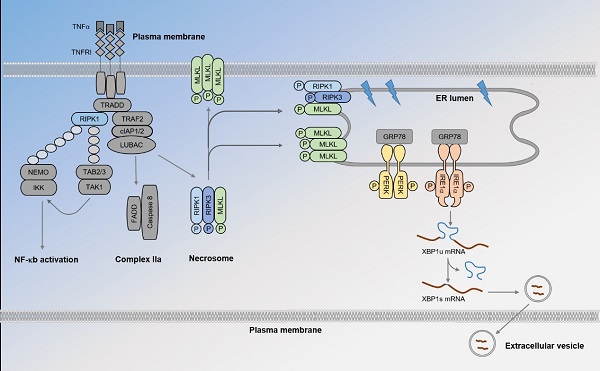
图一 necrosome激活UPR信号通路
中科院上海有机化学研究所生物与化学交叉研究中心袁钧瑛教授是该文章通讯作者,中科院上海有机化学研究所生物与化学交叉研究中心梁伟博士为该文章第一作者。该项研究受国家自然科学基金委、上海市科委、国家重点研发计划和中国科学院资助完成。
文章链接: https://www.pnas.org/content/118/39/e2110476118.long
