
-
中文 | EN

中文 | EN
发布时间:2022-08-16 00:00:00.0
内质网质量控制系统精密地调控并维持着生命体蛋白质稳态水平,将错误折叠或不再需要的蛋白质通过泛素-蛋白酶体途径降解。在内质网关联蛋白质降解过程中,被多聚泛素化修饰的膜蛋白需要特别地从其所驻留的内质网磷脂双分子层膜中逆向转运至细胞质中,才能被位于细胞质中的蛋白酶体所降解。
膜蛋白的跨膜区通常由一个或者多个疏水跨膜螺旋(Transmembrane domains, TMDs)构成,它们整合在内质网膜中,并和膜磷脂紧密地结合。因此,膜蛋白的跨膜逆向转运要克服能量障碍,让疏水跨膜螺旋和磷脂分离,这一过程由AAA-ATPase p97水解ATP产生的拉力来驱动。当某一疏水跨膜螺旋从内质网膜中分离后,其必须被持续地护送直至与p97相结合,以避免其在细胞质的水环境中非特异性聚集或产生不必要的互作,导致蛋白质降解受抑制并引起内质网或细胞应激。然而,膜蛋白的疏水跨膜螺旋持续地被护送至p97的具体机制尚无研究。
2022年8月11日,中国科学院上海有机化学研究所生物与化学交叉研究中心张在荣课题组在国际学术期刊Molecular Cell上在线发表了题为“TMUB1 is an endoplasmic reticulum-resident escortase that promotes the p97-mediated extraction of membrane proteins for degradation”的研究论文。该研究首次发现了TMUB1作为膜蛋白降解过程中跨膜螺旋特异的护送因子,并揭示了TMUB1护送逆向转运的疏水跨膜螺旋从内质网膜转移至p97的分子机制。
该工作以免疫应答相关的受体亚基TAP2和TCRa等多种膜蛋白为研究对象,发现TMUB1能特异性地促进带有强或中等疏水跨膜螺旋的膜蛋白在p97的驱动下从内质网膜向细胞质的转运这一关键过程。当底物膜蛋白跨膜区位于内质网膜磷脂层中时,定位于内质网膜的TMUB1通过跨膜结构域结合底物膜蛋白的疏水跨膜螺旋。随后,在底物跨膜螺旋从内质网膜分离并发生逆向转运的过程中,TMUB1细胞质结构域能临时地结合从磷脂层中出来的约10~14个氨基酸长度的约半个疏水跨膜螺旋。TMUB1的类泛素结构域能招募p97,其将结合在TMUB1细胞质结构域的疏水跨膜螺旋分离并释放到细胞质中。一旦破坏了TMUB1的疏水跨膜螺旋护送功能,膜蛋白的逆向转运无法顺利完成,导致部分肽链跨膜转运、剩余肽链滞留在内质网膜上的底物降解中间体大量累积。
由此,本项工作鉴定了位于内质网膜的疏水跨膜螺旋特异性的逆向转运护送因子。结合多种细胞内和体外重构实验,本工作揭示了在膜蛋白降解过程中,由内质网发生逆向转运而部分暴露在细胞质的疏水跨膜螺旋会持续性地被TMUB1护送的分子机制。TMUB1促进了膜蛋白的逆向转运,其护送功能会缩短经p97作用下发生逆向转运的疏水跨膜螺旋暴露在细胞质的停留时间,避免有害中间体的聚集。该研究也为哺乳动物跨膜蛋白逆向转运这一研究难题提出了新的研究模式,推动了膜蛋白降解和逆向转运这一基本蛋白质运动过程的进一步研究。
中科院上海有机化学研究所生物与化学交叉研究中心张在荣课题组已毕业博士生王林寒,研究生李纪强和科研助理汪清晨为该论文的共同第一作者,张在荣研究员为该论文的通讯作者。该工作得到了交叉中心张耀阳研究员和四川大学曹洋博士的协助和支持。该研究受中国科学院和上海市科学技术委员会资助。
论文下载链接:https://authors.elsevier.com/a/1fZV33vVUPK8Xf
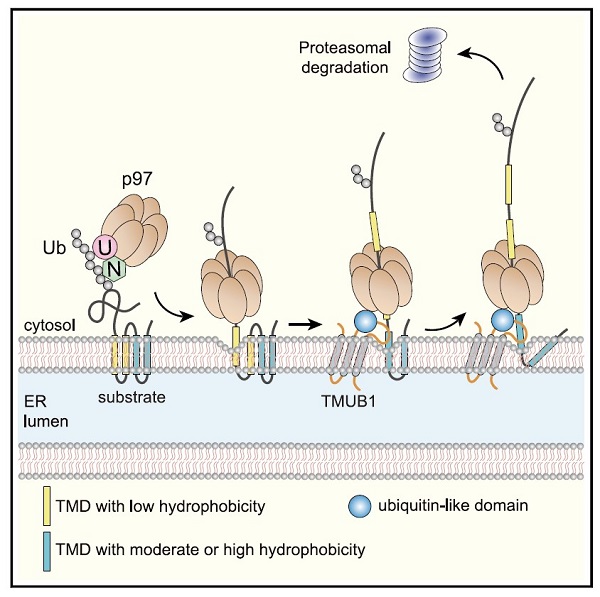
图1,TMUB1护送底物疏水跨膜螺旋从内质网膜转移至p97 ATPase的工作模型
