
-
中文 | EN

中文 | EN
发布时间:2024-02-20 00:00:00.0
近日,刘聪课题组与北京大学第三医院李子健课题组在Circulation杂志在线发表题为“Phosphorylation-Regulated Dynamic Phase Separation of HIP-55 Protects Against Heart Failure”的研究论文。本研究首次确认了在心力衰竭过程中蛋白质相分离及其动态调控发挥保护作用的机制,并揭示了病理性的交感-肾上腺素过度激活导致的蛋白质异常相分离在心衰发展过程中的关键作用。

心力衰竭是众多心血管疾病的终末阶段,其5年生存率甚至低于大多数恶性肿瘤。在心力衰竭的发生和发展过程中,交感-肾上腺素受体的过度激活起着至关重要的作用。β肾上腺素受体在维持心脏生理功能中发挥功能,而当受体被病理性过度激活时,其引发的下游信号通路紊乱与心衰的发生和发展密切相关。因此,深入了解β肾上腺素受体在生理和病理之间的转变机制,以及发现在心衰调控中扮演关键角色的分子,具有极其重要的意义。
在本研究中,作者使用长期交感过度激活导致心力衰竭的动物模型,发现敲除HIP-55促进了心力衰竭的发展;而在心脏中特异性过表达HIP-55则抑制了心衰的进展。这表明HIP-55在心衰中具有内源性的保护作用。
为了揭示HIP-55在心力衰竭中发挥保护作用的机制,作者在细胞层面进行了深入研究。作者发现HIP-55具有液-液相分离的能力,在心肌细胞内能形成颗粒状凝聚体。HIP-55含有一个富集R/E/A/Q的低复杂度结构域,将HIP-55这一结构域中的R突变为A导致其失去相分离的能力,表明电荷相互作用驱动HIP-55相分离。作者还发现,HIP-55的过表达可以抑制与心衰相关的信号通路P38/MAPK的过度激活,而相分离受损的HIP-55则无法实现这一功能。以上结果表明,HIP-55通过调控相分离来抑制交感过度激活引起的信号通路紊乱,从而在心衰中发挥保护作用。
在细胞内,蛋白质相分离是一个受到精细调控且容易受到干扰的生物学过程。过度的应激通常伴随着蛋白质相分离的紊乱,这与多种疾病的发生和发展密切相关。通过对心衰动物模型心脏组织病理切片的观察,作者发现β肾上腺素受体的过度激活会导致内源HIP-55形成大量颗粒状聚集体。进一步的机制研究揭示,交感-肾上腺素系统的过度激活导致了HIP-55的S269/T291位点的磷酸化异常减少。S269/T291的磷酸化能够显著抑制HIP-55的相分离,因此磷酸化异常减少会促使HIP-55过度相分离。随着病理性刺激的持续,HIP-55的过度分相凝集体会逐渐转变为失去功能的不可溶沉淀。这些研究结果表明,交感-肾上腺素受体的过度激活促进了HIP-55的过度相分离和失活沉淀的形成。
为了进一步验证磷酸化动态调控的相分离的关键作用,作者构建了突变体HIP-55 AA (S269A/T291A)。细胞模型和动物模型的数据表明,该突变体会发生过度相分离,导致HIP-55形成大量的不可溶聚集,并丧失了抑制β-AR/P38信号通路过度激活的能力,使其失去心衰保护的功能。这些结果证实了HIP-55动态相分离在心衰保护中的重要作用。
综上所述,本研究揭示了信号接头蛋白HIP-55动态相分离在维持心脏稳态中的关键作用,同时揭示了交感-肾上腺素系统过度激活导致心脏HIP-55蛋白异常相分离,从而介导心衰发生发展的新机制,为心衰的药物开发提供了理论基础和新靶点。
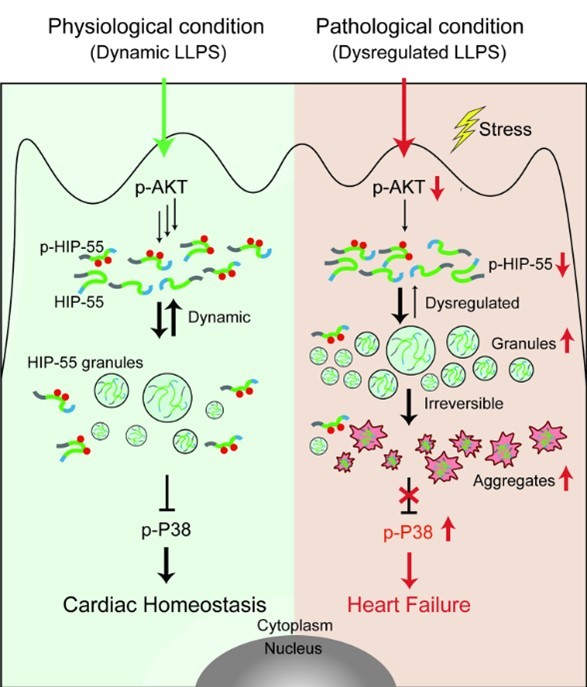
HIP-55动态相分离在心力衰竭中的保护作用
该研究由刘聪课题组与北京大学第三医院李子健课题组共同完成。北京大学第三医院博士后姜允奇,中国科学院生物与化学交叉研究中心博士后谷锦阁(已出站),和北医三院已毕业研究生牛小豆为文章的共同第一作者。该成果得到了国家重点研发计划、国家自然科学基金重点国际合作项目、国家自然科学基金重点区域联合项目、上海市科学技术委员会、中国医学科学院医学科研管理/代谢性心血管疾病基础与临床研究创新单元,北大-清华生命科学联合中心等项目的资助。
原文链接:https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.123.067519
