
-
中文 | EN

中文 | EN
发布时间:2025-02-18 00:00:00.0
帕金森病(Parkinson’s disease, PD)和阿尔兹海默病(Alzheimer’s disease, AD)等神经退行性疾病(NDs)严重威胁人类健康,其核心病理特征之一是淀粉样纤维(amyloid fibrils)的异常聚集,其中最具代表性的蛋白包括α-突触核蛋白(α-syn)、Tau和Aβ。这些蛋白聚集体不仅是疾病的病理标志物,还在神经炎症、细胞损伤及疾病传播过程中发挥关键作用。因此,科学界围绕如何利用化学小分子干预或破坏这些病理淀粉样纤维开展了广泛研究。近年来,冷冻电镜(Cryo-EM) 技术的突破显著推动了我们对这些病理性纤维原子结构的理解,然而,其通常依赖于对成千上万条病理纤维的静态平均信息,我们对于单个病理性纤维在溶液中的力学特性及其与化学小分子的相互作用仍知之甚少。

近日,中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组与上海科技大学生科院孙博课题组合作,在Advanced Science 发表了题为 “Single-molecule Insight into α-Synuclein Fibril Structure and Mechanics Modulated by Chemical Compounds” 的研究论文。该研究开发了一种基于光镊(Optical Tweezers, OT)和荧光显微成像的单分子研究方法,实现了对α-syn单根纤维的力学特性表征,并结合冷冻电镜揭示了不同化学小分子如何调控纤维的构象以及力学性质。相应的研究为在单分子水平探索神经退行性疾病致病淀粉样蛋白聚集的机制及发展其干预策略提供了全新视角。
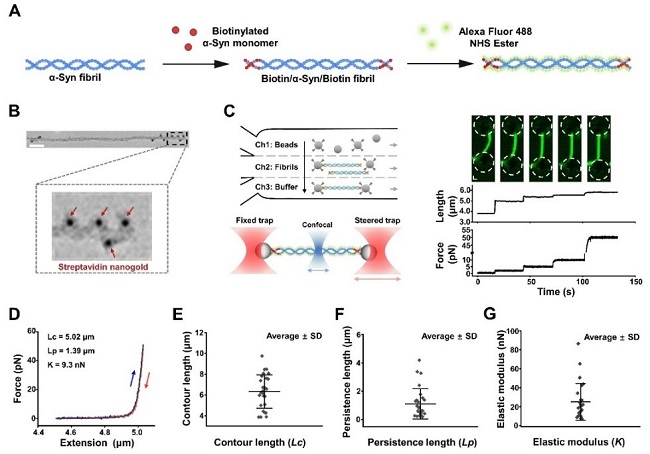
图1. 开发单分子研究方法表征α-syn纤维的力学特性
研究亮点:
1. 首次揭示α-syn纤维的单分子力学特性
本研究通过光镊实验,发现α-syn纤维是一种高度刚性的生物聚合物,且其形变和断裂特性具有显著的异质性。传统方法(如酶切,超声等)通常得到的是大量纤维平均后的稳定性信息,而本研究提供了单根纤维的力学测量结果,揭示了单根纤维在力学稳定性上的显著差异。这一发现有助于更精准地理解淀粉样纤维在疾病中的作用。
2. 光镊结合冷冻电镜,实现多尺度病理纤维表征及调控
本研究首次建立了光镊结合Cryo-EM的综合生物物理研究方法,不仅能够观察蛋白聚集体的静态结构,还能直接测量其在溶液中的力学特性。这一方法突破了传统结构生物学的局限性,为研究其他病理性淀粉样纤维及其与不同小分子相互作用提供了通用性平台。
3. 阐释不同化学分子对α-syn纤维力学特性差异性调控新机制
本研究进一步探索了两种化学小分子——表没食子儿茶素没食子酸酯(EGCG)和叶绿素铜A(CCA)对α-syn纤维结构和力学特性的调控作用,研究人员发现EGCG 可嵌入α-syn纤维N端极性沟槽,破坏纤维核心稳定性,并诱导纤维解聚。而CCA 通过结合α-syn纤维的多个不同位点,提高其抗断裂能力,使纤维更加稳定。通过冷冻电镜结构解析,研究团队发现EGCG和CCA作用于不同的纤维界面,分别导致纤维力学特性的相反变化。这一结果表明,针对不同的纤维界面进行靶向干预,可能成为调控α-syn病理纤维的新策略,为未来开发帕金森病等疾病的新型治疗药物分子提供了新的线索。
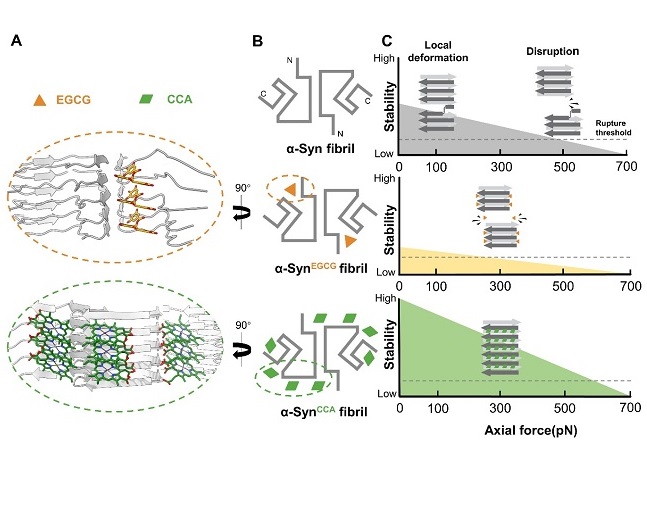
图2. 不同化学小分子对α-syn纤维力学特性及结构的调控机制
综上,本研究首次在单分子层面系统解析了α-syn纤维的力学特性,并揭示了其异质性,突破了传统方法的静态平均化局限。此外,通过创新性地将光镊与冷冻电镜技术相结合,开创了一种可同时解析蛋白聚集体结构和力学特性的新策略,这一方法未来可广泛应用于其他病理性纤维的研究。本研究发现,不同小分子可通过不同结合界面影响α-syn纤维的稳定性,从而提供了新的药物筛选策略,为帕金森病及其他神经退行性疾病的治疗开辟了新路径。本研究不仅加深了对帕金森病病理纤维的基本认知,也为未来基于纤维力学特性调控的新型神经退行性疾病药物开发提供了重要的理论依据。
本研究由中国科学院上海有机化学研究所刘聪课题组,上海科技大学生命科学与技术学院孙博课题组合作共同完成,刘聪研究员,孙博教授为本文的共同通讯作者;上海交通大学Bio-X研究院博士生李想,孙博课题组的助理研究员毕路路博士为文章的共同第一作者。该工作得到了国家自然科学基金委、科技部、上海科技大学生命学院发展基金及上海市科委等项目及基金的资助。
论文链接:http://doi.org/10.1002/advs.202416721
