
-
中文 | EN

中文 | EN
发布时间:2025-04-11 00:00:00.0
文章背景
神经退行性疾病中的蛋白病理传播难题
帕金森病(PD)、路易体痴呆(DLB)等突触核蛋白病(Synucleinopathies)的核心特征之一是病理蛋白α-突触核蛋白(α-synuclein)的异常聚集和跨神经元传播。尽管病理传播机制与疾病进展密切相关,但长期以来,病理种子(如纤维)在传播过程中的动态变化及其分子机制仍不清楚。此外,淀粉样纤维的“柔性外壳”(fuzzy coat)——位于纤维核心外侧的柔性区域——因其无序性和技术限制,其功能研究几乎空白。
文章介绍
中国科学院上海有机化学研究所生物与化学交叉研究中心贺焯皓团队揭示α-突触核蛋白病理传播的核心机制
中国科学院生物与化学交叉研究中心研究团队联合中国科学技术大学合作者,通过多学科交叉研究,首次阐明了α-突触核蛋白纤维的柔性外壳区域在病理传播中的关键作用 (图1),相关成果发表于Neuron。
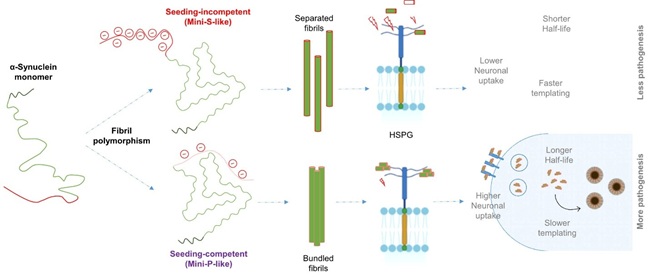
图1 α-突触核蛋白纤维的柔性区域在病理传播中的关键作用
主要发现有:
1. 由于病理蛋白多态性的存在,病理蛋白致病活性随传播逐步衰减
通过体外模拟病理种子的连续扩增(图2A),研究团队发现:初始纤维(P1)在神经元中的病理诱导活性显著高于多次传代后的纤维(P8)(图2B)。进一步分离出两种纤维多态体Mini-P(高致病毒性)和Mini-S(低致病毒性),发现其比例变化是致病毒性衰减的主因(图2C-E)。
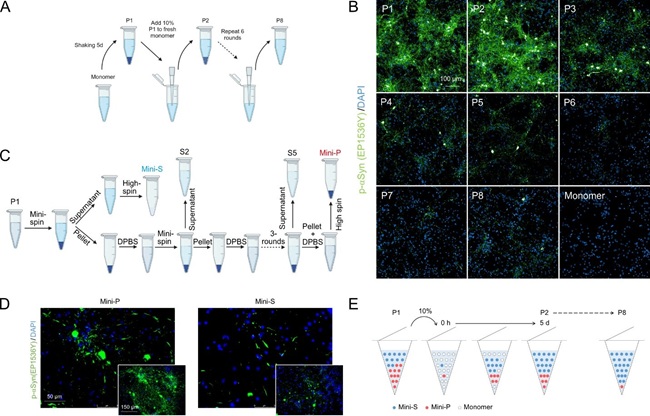
图2 α-突触核蛋白的多态性和其致病毒性相关
2. 模糊外层与核心区域之间的相对空间关系影响蛋白性质及其致病毒性
通过冷冻电镜(cryo-EM),固态核磁共振(ssNMR)解析发现:Mini-P和Mini-S的纤维核心结构高度相似(图3A),但柔性外壳的动态性差异显著(图3B)。通过氢氘交换质谱(HDX-MS)推测Mini-P的C端柔性外壳与核心结合更紧密(图3C),减少了负电荷暴露(图2D),增强了与神经元表面受体HSPG的亲和力(图3E),同时减少空间位阻,更易抱团抵抗细胞内蛋白酶降解,作为种子存留时间更长(图3F-G)。
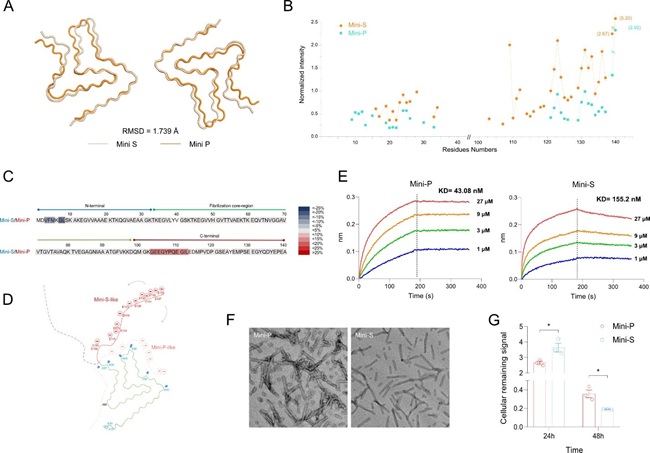
图3 病理种子蛋白多态性的分子机理分析
3. 临床验证:人类患者脑内活跃病理与Mini-P特性匹配
利用构象选择性抗体,研究团队在突触核蛋白病患者的病理新发脑区(如扣带回皮层)中,检测到Mini-P特异性病理信号(图4),提示活跃传播的病理种子可能具有类似的电荷屏蔽和受体结合特性。
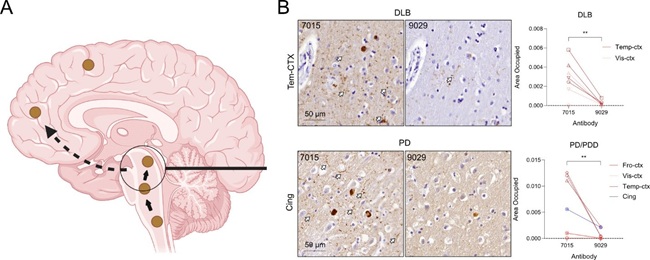
图4 帕金森病等病人脑内存在着致病多态性的核突触病理蛋白
总结
科学意义与转化潜力
该研究首次揭示了α-突触核蛋白纤维“柔性外壳”通过与核心区表面带正电的氨基酸残疾相互作用,精妙调控其电荷分布,进而影响病理纤维存在形式及性质,决定其进入神经元的效率和细胞内播种能力弱,从而表现出病理传播活性多态性的全新机制,挑战了“纤维核心决定病理特性”的传统观点。这一发现为神经退行性疾病的诊断和治疗提供了新思路:
1.诊断标志物:Mini-P样活跃病理的检测或可评估疾病进展。
2.治疗靶点:靶向柔性外壳,通过调节其和核心区的相对空间位置,将高活性纤维转化为低活性形式,有望阻断病理传播;而非将病理蛋白全部降解的传统策略和方法。
3.跨疾病启示:类似机制可能存在于tau蛋白、β淀粉样蛋白、TDP43等其他病理蛋白中,为广谱治疗策略奠定基础。
研究团队与支持
中国科学院上海有机化学研究所生物与化学交叉研究中心贺焯皓、刘聪研究员与中国科技大学项晟祺教授为本论文的共同通讯作者;交叉中心韩雨良硕士,研究生夏文程以及中科大李娟博士为共同第一作者。本研究获中国科学院、国家自然科学基金委、科技部重点研发计划、上海市科委等项目支持。
原文链接:https://www.cell.com/neuron/fulltext/S0896-6273(25)00219-3
