
-
中文 | EN

中文 | EN
发布时间:2025-04-17 00:00:00.0
泛素化修饰是一种在哺乳动物细胞中普遍存在的蛋白质翻译后修饰形式,几乎参与所有重要的细胞过程。泛素化修饰主要包括单泛素化修饰以及通过不同连接方式形成的多泛素化修饰,其中K48型泛素链修饰主要参与细胞中的泛素-蛋白酶体降解途径,负责细胞内蛋白质的质量控制。福氏志贺氏菌(S. flexneri)是一种革兰氏阴性致病菌,是细菌性志贺氏菌病的主要元凶,每年导致全球很多病例死亡。在入侵宿主细胞时,福氏志贺氏菌会分泌多种效应蛋白来促进其在宿主细胞中的生存和增殖。其中,效应蛋白IpaH1.4是福氏志贺氏菌分泌的一种NEL型E3泛素连接酶,可通过介导相关宿主蛋白的K48型泛素化修饰和蛋白酶体降解来抑制宿主的相关天然免疫反应。但是,目前IpaH1.4可靶向的人源宿主蛋白以及相关的作用机制仍不是非常清楚。
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心张一小团队与生命过程小分子调控全国重点实验室的潘李锋团队、以及上海交通大学医学院的姚玉峰团队合作在Nature Communications杂志发表了题为 Shigella effector IpaH1.4 subverts host E3 ligase RNF213 to evade antibacterial immunity 的文章,首次揭示了福氏志贺氏菌释放的E3效应蛋白IpaH1.4通过靶向宿主免疫关键蛋白RNF213并介导其发生K48型泛素化修饰和蛋白酶体降解,从而逃脱RNF213介导的宿主抗入侵细菌的天然免疫过程,为后续进一步研究相关致病菌拮抗宿主免疫过程提供了新的方向。

在本项研究中,该研究团队首先通过亲和质谱鉴定,发现免疫关键因子E3泛素连接酶RNF213为福氏志贺氏菌效应蛋白IpaH1.4在人源宿主细胞内的又一个重要的靶标底物蛋白。作为首个被报道的、可介导多糖泛素化修饰的E3泛素连接酶,RNF213可直接泛素化入侵细菌表面的脂多糖(LPS),之后再通过LPS上的泛素化修饰来启动抗入侵细菌的天然免疫反应。随后,通过系统的生物化学、结构生物学和细胞生物学分析,该研究团队首次揭示福氏志贺氏菌的E3效应蛋白IpaH1.4能够通过其LRR结构域与RNF213的RING结构域的特异性相互作用直接靶向人源RNF213,并在细胞内介导RNF213的K48型泛素化修饰及蛋白酶体降解。进一步,该研究团队解析了人源RNF213的冷冻电镜结构以及IpaH1.4 LRR/RNF213 RING复合物的晶体结构,详细阐明了IpaH1.4特异性识别RNF213的分子机制。最后,基于细胞水平的病原菌侵染等功能实验,该研究团队证明了IpaH1.4对宿主RNF213的靶向作用促进了福氏志贺氏菌在感染细胞内的增殖。
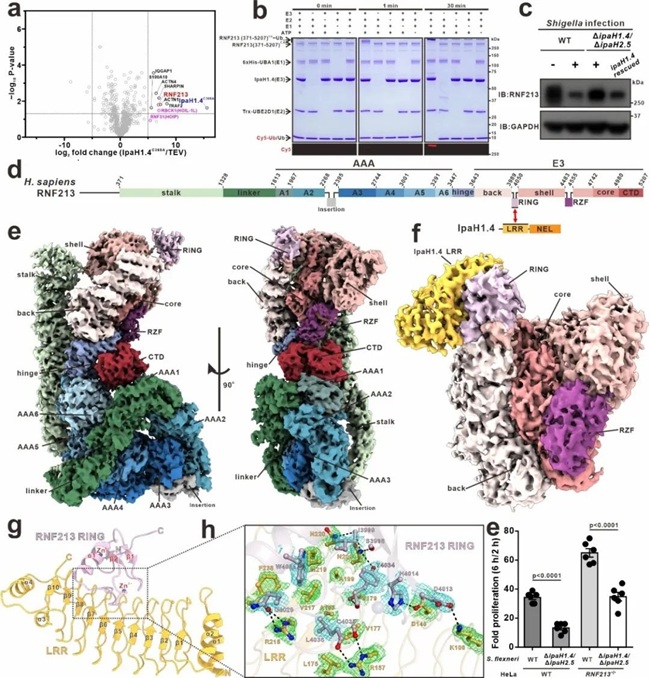
图1: 福氏志贺氏菌E3效应蛋白IpaH1.4拮抗免疫相关蛋白RNF213的作用机制
基于本研究的发现及先前关于RNF213泛素化修饰脂多糖(LPS)的报道,该团队提出了福氏志贺氏菌在入侵宿主细胞过程中通过效应蛋白IpaH1.4来破坏RNF213介导的宿主抗入侵病原体的相关天然免疫过程的作用模型:当福氏志贺氏菌侵入宿主细胞质后,其外膜上的LPS分子会被RNF213特异性识别;RNF213进一步介导LPS的泛素化修饰,并招募LUBAC复合物在入侵细菌表面介导线性泛素化链的形成;随后,下游线性泛素链结合蛋白(如NEMO和Optineurin)被募集,从而触发炎症反应和降解入侵病原体的选择性自噬过程,以抑制细菌在宿主细胞内的生存和增殖;然而,福氏志贺氏菌可通过分泌E3效应蛋白IpaH1.4,利用本研究揭示的IpaH1.4 LRR结构域与RNF213 RING结构域的特异性相互作用,直接靶向并劫持RNF213;随后,IpaH1.4能够介导RNF213的K48连接型泛素化修饰及蛋白酶体降解,从而拮抗RNF213介导的宿主抗入侵细菌的天然免疫过程,进而利于福氏志贺氏菌在宿主细胞内的生存和增殖。
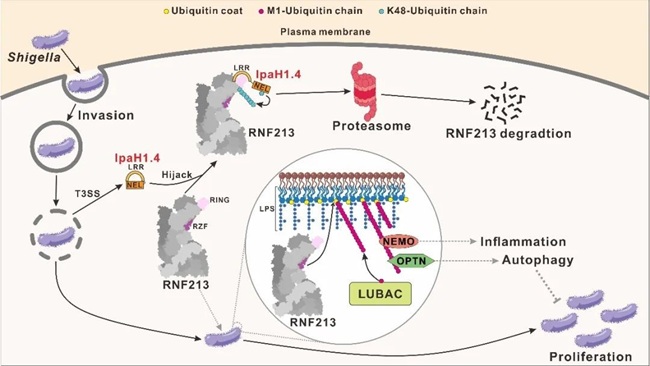
图2: 福氏志贺氏菌通过E3效应蛋白IpaH1.4/2.5拮抗宿主RNF213的模型示意图
综上所述,该研究工作首次发现RNF213是福氏志贺氏菌效应蛋白IpaH1.4的一个新颖宿主靶标蛋白,并通过解析相关的复合物结构详细阐明了IpaH1.4靶向作用于人源RNF213的分子机制,进而揭示了福氏志贺氏菌通过劫持宿主关键免疫因子RNF213来促进细菌入侵和增殖的一种新策略,为未来抗福氏志贺氏菌感染的药物研发提供了新的潜在作用靶标。
中国科学院上海有机化学研究所博士研究生周鑫頔、博士研究生张慧晶、已毕业的王亚茹博士和上海交通大学医学院王丹霓副教授为本论文的共同第一作者,潘李锋研究员、张一小研究员以及姚玉峰教授为该论文的共同通讯作者。该论文中相关的质谱鉴定工作得到了上海蛋白质中心质谱团队的大力支持。
原文链接:https://www.nature.com/articles/s41467-025-58432-y
