
-
中文 | EN

中文 | EN
发布时间:2025-06-04 00:00:00.0
帕金森病(Parkinson’s disease, PD)作为全球第二大神经退行性疾病,目前尚无根治性的治疗手段。α-突触核蛋白(α-synuclein,α-syn)是PD的关键致病蛋白,病理性α-syn聚集可能是导致神经退行的主要原因,因此靶向αsyn是治疗PD极具潜力的治疗手段。相较于目前临床尝试的人源单克隆抗体,小分子药物具有独特优势:更易于透过血脑屏障,更易于生产被制成口服药片,免疫原性低。针对α-syn蛋白的“不可成药”特性,利用小分子靶向其上游调控基因实现对病理性α-syn蛋白的清除可能为疾病干预提供新方向。
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员与复旦大学鲁伯埙教授、复旦大学华山医院王坚教授在Science Translational Medicine杂志上发表题为“MEK1/2 inhibitors suppress pathological α-synuclein and neurotoxicity in cell models and a humanized mouse model of Parkinson’s disease”的文章。该研究发现了可在上游调控αsyn蛋白水平的因子——MEK1/2,揭示了MEK1/2抑制剂具体的分子作用机制,验证了口服能通过小鼠血脑屏障的MEK1/2抑制剂在一个全新的人源化PD小鼠模型中对PD病理表型的挽救疗效,凸显了MEK1/2抑制剂在PD等共核蛋白病上的治疗潜力。

研究团队通过工具化合物库筛选,鉴定出MEK1/2抑制剂C084可降低细胞内α-syn水平,MEK1/2抑制剂C425具有对MEK1/2激酶活性的抑制与对α-syn水平的降低作用。MEK1/2抑制剂降低可溶性与病理性α-syn蛋白水平的疗效在多种细胞系与小鼠原代培养神经元模型得到了充分验证。随后研究团队对其具体的分子作用机制进行了系统的探究,揭示了MEK1/2-ERK2信号通路通过独立但互补的双重通路的分子作用机制(图1):一方面通过降低TFEB在Ser142处磷酸化水平促进其核内表达,进而激活自噬降解可溶性α-syn蛋白;另一方面通过抑制PLK2激酶mRNA水平减少129位丝氨酸磷酸化α-syn(p-αsyn)的生成。自噬与PLK2共同介导MEK1/2抑制剂调控α-syn聚集体水平。
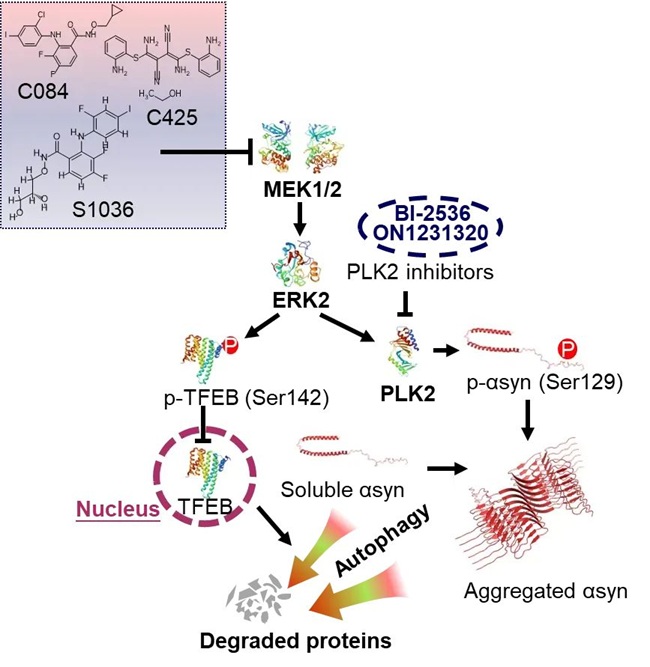
图1. MEK1/2-ERK2信号通路的分子作用机制
为了更加真实模拟PD患者的病理特征,该研究团队利用CRISPR-Cas9技术,将编码人类α-syn蛋白的基因SNCA的编码区敲入野生型小鼠中,构建了一个全新的人源SNCA敲入小鼠模型,并结合α-syn-PFF纹状体注射方法进行PD小鼠造模,验证了口服MEK1/2抑制剂在挽救多巴胺能神经元死亡、改善小鼠行为学表型及降低包括病理性α-syn在内的一系列等分子水平的显著疗效。
综上,本项研究通过PD细胞与动物模型实验证明了抑制MEK1/2-ERK2通路可减少病理性α-syn蛋白水平及其相关病理性改变,并在人源SNCA敲入PD小鼠模型中口服可过血脑屏障的MEK1/2抑制剂可提供潜在的治疗益处,展现出MEK1/2抑制剂老药新用的临床转化潜力,为PD等共核蛋白病的靶向治疗提供了新思路。值得一提的是在本工作发表后,Nature reviews drug discovery专门撰文作为近期研究亮点介绍了本工作。

复旦大学生命科学学院鲁伯埙教授、中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员及复旦大学华山医院王坚教授是本文共同通讯作者。复旦大学生命科学学院博士生王慧兰、王晴、徐浩翔为该论文的共同第一作者。本研究工作得到了国家自然科学基金项目、上海尚思自然科学研究院项目及中国科学院战略重点研究项目的支持。
原文链接:https://www.science.org/doi/10.1126/scitranslmed.adp4625
